- Products
- Oncohematology
- Antibodies
- Kits
- CAR T-cell
- Euroflow
- Single reagents
- Request info
- Resources and support
- Immunology
- Antibodies
- Single reagents
- Cross match determination (FCXM)
- FcεR1
- Ig subclasses
- Single reagents
- Kits
- TiMas, assessment of tissue macrophages
- Request info
- Resources and support
- Antibodies
- Exosomes
- Accesory reagents
- Software
- Oncohematology
- Services
- Peptide Production
- Design
- Modification
- Protein Services
- Expression and purification
- Freeze drying
- Monoclonal And Polyclonal Antibody Development
- Monoclonal
- Policlonal
- Specialized antibody services
- OEM/Bulk production
- Purification
- Conjugation
- Custom Exosome Services
- Isolation and purification
- Characterization
- Peptide Production
- Shop
- Support
- About Us
- Contact
Dextranos:
Los dextranos, polisacáridos extraídos de forma natural de las bacterias, son usados en medicina para numerosas aplicaciones como portadores de fármacos o vacunas, pero también pueden usarse para incorporar otras moléculas de interés.
REFERENCIAS DE PRODUCTOS
| Product name | Reference | Description | |
|---|---|---|---|
Fluorescent Streptavidin Dextrans-25T | DXPESTV-25T | PE Fluorescent Streptavidin Dextrans | RUO | 25 test | GO TO SHOP |
Fluorescent Streptavidin Dextrans-100T | DXPESTV-100T | PE Fluorescent Streptavidin Dextrans | RUO | 100 test | GO TO SHOP |
Tal es el caso de los dextranos fluorescentes, donde se acoplan fluorocromos, ya sean sintéticos (FITC) o proteicos (PE o APC), y estreptavidina, proteína con una alta afinidad por la biotina y con cuatro sitios de unión disponibles.
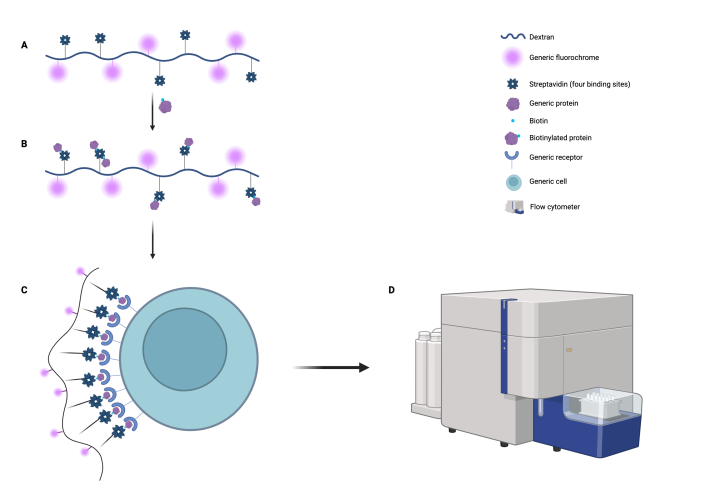
Este complejo dextrano-fluorocromo-estreptavidina (Fig. 1A) permite unir, mediante el sistema biotina-estreptavidina, cualquier molécula biotinilada (Fig. 1B). Esta molécula incorporada, antígeno, podrá usarse para unir todo el complejo a una célula objetivo, u otro sistema establecido, (Fig. 1C) y ser detectada por citometría de flujo por medio del fluorocromo (Fig. 1D).
Figura 1: Sistema de señalización de dextrano
Nueva vía
Este sistema es una alternativa a las conjugaciones convencionales entre proteínas de interés (antígenos) y fluorocromos; estas conjugaciones son directas en el sentido de que se crea un enlace entre las dos moléculas. El dextrano ofrece ciertas ventajas sobre el método convencional:
-
-
Reconocimiento eficaz del antígeno. El antígeno no se conjuga directamente con el fluorocromo, lo que a menudo dificulta el reconocimiento debido al impedimento estérico, sino que se une a la estreptavidina y queda distante y reconocible debido al espacio creado entre las moléculas a lo largo del dextrano. Esto mejora enormemente la unión antígeno-receptor. Es preferible que el antígeno esté monobiotinilado para no comprometer la zona de reconocimiento.
-
Presentación optimizada del antígeno. Es más eficaz porque se trata de un multímero; hay numerosas moléculas de antígeno en el dextrano, por lo que es más probable que se reconozcan una o varias y la unión es más estable.
-
Amplificación de la señal. Permite discriminar la población positiva de la negativa con cantidades muy bajas, ya que la presentación y el reconocimiento están optimizados y no se necesita un título demasiado elevado.
-
Bajo marcaje inespecífico. Al no tener que añadir cantidades elevadas para separar la población específica, el marcaje inespecífico se reduce significativamente, agrupándose e identificándose.
-
Detección de poblaciones minoritarias. Todas las cualidades anteriores contribuyen a poder discriminar poblaciones muy pequeñas (por debajo del 0,5%) con alta resolución.
-
Conjugación rápida y eficaz. Al basarse en un sistema biotina-estreptavidina, la conjugación sólo dura 30 minutos; es necesario probar diferentes cantidades para establecer la mejor proporción de proteína biotinilada y dextrano, pero no se requieren pasos de purificación, ya que la mejor proporción ofrece la máxima eficacia sin pérdidas.
-
Unión antígeno-receptor
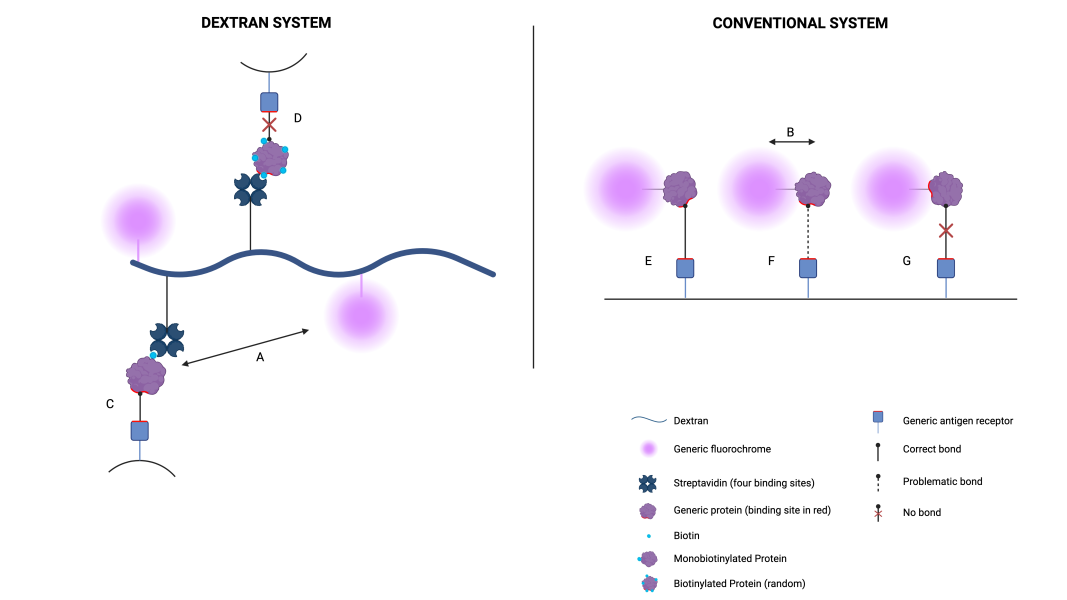
Figura 2: Unión antígeno-receptor comparando la conjugación con dextrano con la conjugación convencional.
A-B) Observamos la diferencia de espaciado entre el fluorocromo y la proteína; el espaciado en el dextrano (A) es mayor que en una conjugación convencional (B), lo que favorece la unión, como puede verse en la comparación de las uniones C y F. El sitio de unión en F está parcialmente impedido por el espaciado del fluorocromo.
C-D) Comparamos la unión de una proteína monobiotinilada (C) con una biotinilada normal aleatoria (D). Se observa que la conjugación aleatoria compromete el reconocimiento de la proteína, ya que el sitio de unión puede conjugarse con la biotina y unirse a la estreptavidina o la proteína puede volverse espacialmente irreconocible. La monobiotinilación es selectiva y el sitio de unión queda asegurado.
E-F-G) En una conjugación convencional, pueden darse tres situaciones con respecto a la unión: unión correcta (E), unión problemática (F) y ausencia de unión (G). Esto ocurre porque la conjugación es aleatoria y el sitio de unión puede ser más o menos accesible; esto no ocurre en el dextrano (como se ve en C).
Marcado de células
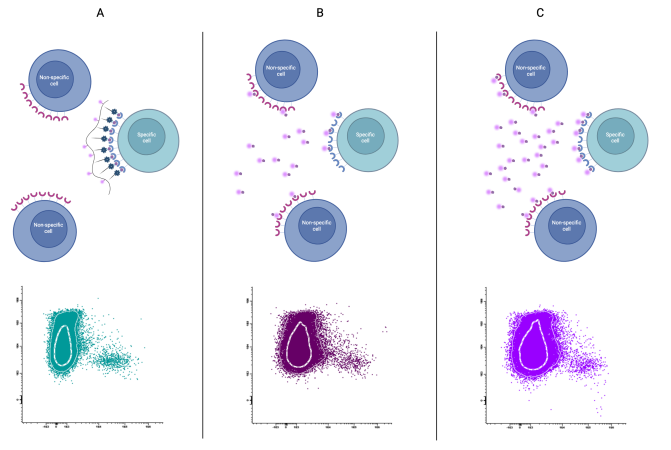
Figura 3: Comparamos el sistema de etiquetado celular con dextrano fluorescente (A) con el sistema convencional (B y C).
A) Observamos que no es necesario añadir una gran cantidad de dextrano para etiquetar correctamente la población específica, ya que se trata de una unión eficiente. Esto significa que evitamos añadir demasiado reactivo que provoque un marcaje inespecífico y, por lo tanto, conseguiremos una separación óptima.
B) Con una cantidad baja de reactivo, no tenemos una separación suficiente porque tenemos un marcaje inespecífico, bien por la proteína o bien por el fluorocromo. Esto ocurre, sobre todo, porque la conjugación proteína-fluorocromo no es eficiente y tenemos moléculas que no son funcionales, pero sí provocan uniones inespecíficas, lo que nos obliga a aumentar el título para unir la célula específica.
C) Si aumentamos el título (o lo optimizamos), podemos conseguir una mejor separación, pero con el riesgo de aumentar la unión inespecífica por exceso de reactivo. La separación no es tan eficaz como con el dextrano.
Se aplican en:
Monitorización de la respuesta inmune a vacunas detectando linfocitos B antígeno-específico; poblaciones muy pequeñas que son difíciles de detectar y discriminar con métodos convencionales, pero que no resultan un problema para los dextranos fluorescentes.
La terapia autóloga de cáncer que utiliza linfocitos T modificados, los cuales se deben detectar. Esta detección suele presentar problemas, ya sea por la proteína de detección como por el número de células modificadas y su expresión de receptor CAR; los dextranos fluorescentes permiten resolver estos problemas.
Bien puede ser el caso de necesitar esta vía para aquellas proteínas que son difíciles de conjugar por métodos convencionales; además, ofrece mejores resultados para detectar poblaciones muy pequeñas.
El número y la disposición de los antígenos que se incorporan en el dextrano fluorescente permiten una presentación a las células muy eficiente a la hora de buscar su activación, la cual será más probable y eficiente.
Preguntas frecuentes
Sí, pero debe estar conjugada con biotina (biotinilada) para poder hacer uso del sistema biotina-estreptavidina y que se una al dextrano.
Sí, cualquier molécula biotinilada es compatible con los dextranos, pero siempre habrá que titular la cantidad de molécula por dextrano para optimizar el reactivo.
Sí, puede haber excepciones, pero es habitual que funcione significativamente mejor estando monobiotinilada, dado que la conjugación es dirigida a una zona alejada del sitio de reconocimiento. Aun así, también funciona el sistema con biotinilados normales.
No, no es necesaria ninguna purificación, en tanto que se titula la cantidad que se añade al dextrano para que no exista un exceso que interfiera en el ensayo.
No es necesario, pero se puede diluir en el buffer deseado, teniendo en cuenta que se debe añadir un buffer estable para la mezcla final si se va a conservar
mucho tiempo diluido. Sí es necesario calcular el volumen por test en función de la ficha técnica del producto (TDS).
Sí, los dextranos fluorescentes presentan pocas o nulas interferencias, tanto con otros reactivos como con diferentes muestras biológicas.