- Productos
- Oncohematología
- Inmunología
- Anticuerpos
- Reactivos individuales
- Determinación de compatibilidad cruzada (FCXM)
- FcεR1
- Subclases Ig
- Reactivos individuales
- Kits
- Solicitar información
- Recursos y soporte
- Anticuerpos
- Exosomas
- Reactivos accesorios
- Software
- Tienda
- Servicios
- Síntesis de Péptidos
- Diseño
- Modificación
- Servicios de Proteínas
- Expresión y purificación
- Liofilización
- Desarrollo de anticuerpos
- Monoclonal
- Policlonal
- Servicios especializados de anticuerpos
- OEM/Producción a granel
- Purificación
- Conjugación
- Servicios de exosomas
- Aislamiento y purificación
- Caracterización
- Síntesis de Péptidos
- Soporte
- Sobre nosotros
- Contacto
Producción de Péptidos
Un péptido es un compuesto, natural o sintético, que contiene dos o más aminoácidos unidos por un grupo carboxilo de uno de los aminoácidos y el grupo amino de otro. Las moléculas peptídicas son estructuralmente iguales a las proteínas, pero suelen ser más pequeñas. Hay muchos péptidos que funcionan de diversas maneras, por ejemplo como hormonas, antibióticos y otros compuestos que participan en muchas de las actividades metabólicas de los organismos vivos.
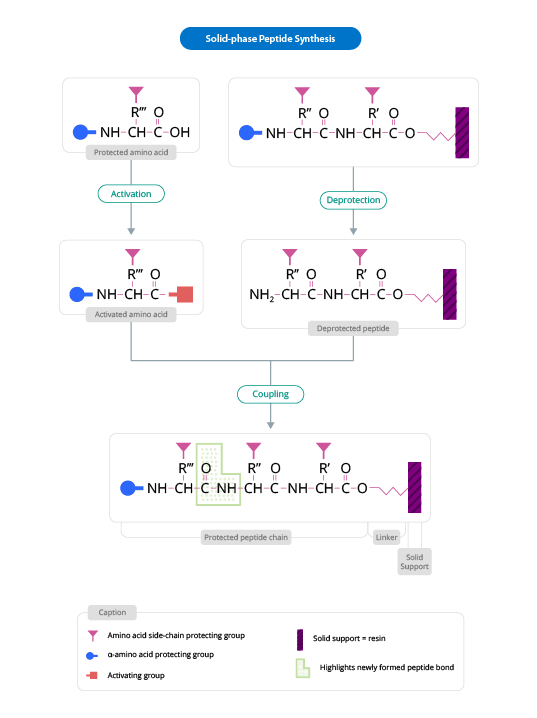
Síntesis de Péptidos en fase sólida
Este método de síntesis peptídica se basa en la incorporación de N-α-aminoácidos en la secuencia de cualquier péptido requerido anclado a una matriz sólida que actúa como soporte. En el proceso de síntesis peptídica, los reactivos solubles se lavan generalmente al final de la adición (de cada aminoácido). Una vez obtenido el péptido deseado, se libera del soporte polimérico.
Solid support
The solid support is a synthetic polymer that becomes attached to groups of reagents with -OH.
These groups are designed so that they can easily react with the carboxyl group of an N-α-amino acid, protected at its carboxyl terminus; it is thus covalently attached to the polymer.
The protection of the amine group (X) may be removed, and a second N-α-amino acid will become attached to the anchored amino acid. The steps described are repeated until the desired sequence is obtained. When the synthesis has finished, a reagent releases the carboxyl terminus from its attachment to the matrix, leaving the required peptide in solution
Desde 2001, hemos diseñado y sintetizado multitud de péptidos que han sido utilizados por nuestros clientes en prácticamente todas sus áreas de trabajo, muy especialmente en investigación.
Estamos deseando conocer sus necesidades
Diseño de péptidos
La síntesis de péptidos puede ser sencilla, pero hay que respetar una serie de factores antes de comenzarla. La secuencia, la composición de aminoácidos y la longitud de los péptidos pueden influir en el correcto ensamblaje de los aminoácidos, así como en la posterior purificación. Estos factores afectarán a la solubilidad del producto final. A la hora de diseñar péptidos, deben tenerse en cuenta los siguientes puntos para que nuestros clientes reciban el producto ideal que se adapte a sus necesidades:
Esto afecta no sólo a la facilidad de ensamblaje de los aminoácidos, sino también a la solubilidad, la estabilidad y el posterior proceso de purificación.
La mayoría de los péptidos de interés, como los utilizados como antígenos, proceden de los extremos N-terminal, C-terminal o del interior de una secuencia de proteínas nativas, por lo que estos péptidos no siempre son ideales.
Algunos pueden ser insolubles o inestables, otros pueden causar problemas de purificación, mientras que, en otros casos, el plegamiento puede no ser similar al de las proteínas nativas.
Gracias a la experiencia adquirida a lo largo de los años, en Immunostep podemos localizar esos aminoácidos problemáticos y modificarlos mejorando las cualidades de los péptidos sintetizados.
Durante la producción se pueden realizar diversas modificaciones en función de las necesidades de nuestros clientes, por ejemplo, cubrir regiones N-term o C-term, según sea necesario, realizar modificaciones químicas, insertar espaciadores o sustituir aminoácidos «problemáticos».
Uno de los factores más críticos en la síntesis y purificación es la longitud excesiva. Por ejemplo, en Immunostep recomendamos no superar nunca los 10-15 aminoácidos para los péptidos utilizados como antígenos, ya que serán ideales al mantener la estructura del epítopo lineal en las proteínas nativas.
La hidrofobicidad afecta considerablemente a la solubilidad de los péptidos; en este sentido, nuestra experiencia nos permite aumentar la solubilidad de los péptidos adaptando la frecuencia de los distintos aminoácidos en función de sus características hidrófilas y/o hidrófobas.
Los péptidos de alta incidencia, como el triptófano, la leucina, la valina, la metionina, la fenilalanina o la isoleucina, pueden no disolverse en soluciones acuosas, lo que nos permite mantener la proporción de estos aminoácidos hidrófobos por debajo del 50%, asegurando al mismo tiempo la existencia de al menos un aminoácido cargado por cada cinco residuos.
En pH fisiológico, la arginina, la glutamina, el ácido aspártico y la lisina están cargados en sus cadenas laterales. Un simple cambio o la eliminación de algunos residuos polares en los extremos N-term o C-term puede influir positiva o negativamente en la solubilidad.
Durante el proceso de síntesis del péptido, la formación de láminas β puede afectar a la solvatación y a la síntesis ordenada del péptido, provocando pérdidas en sus diferentes zonas.
Podemos reducir el número de estas eliminaciones y la aparición de productos no deseados en la síntesis recomendando la eliminación de zonas en las que haya múltiples o adyacentes residuos de valina, isoleucina, tirosina, fenilalanina, triptófano, leucina, glutamina o treonina. En la mayoría de los casos, los cambios conservadores, así como otras medidas aplicadas durante la síntesis, pueden mejorar las posibilidades de éxito en cuanto a pureza y calidad. Medidas como la inserción de glicina o prolina, cada tres residuos, o la sustitución de glutamina por asparagina, o de treonina por serina.
Modificación de Péptidos
A menudo nos encontramos con que nuestros clientes requieren diversas modificaciones de los péptidos ya desarrollados. Estas modificaciones son habituales en distintos experimentos y requieren la experiencia de un grupo acostumbrado a ello.
-
D-aminoácidos
-
Modificaciones del término C: Amidación, lys(Biotina), Lys (FAM)
-
Modificaciones N-term: Acetilación, Ácido mirístico, Ácido palmítico, Ácido fórmico, Biotina
-
Etiquetado fluorescente N-term: FAM, FITC, TAMRA
-
Modificaciones de la cadena lateral Lys: Lys (AC), Lys (Biotina)
-
Fosforilación. Fosforilación-Ser, Fosforilación-Thr, Fosforilación-Tyr
-
Ciclación. Primer puente disulfuro, segundo puente disulfuro, ciclización cabeza-cola
-
Conjugación. KLH BSA
-
Péptido Antígeno Múltiple (MAP) 4 ramas, 8 ramas